ÁCIDOS NUCLEICOS
Introducción


Todas
las células contienen la información necesaria para realizar distintas
reacciones químicas mediante las cuales las células crecen, obtienen energía
y sintetizan sus componentes. Está información está almacenada en el
material genético, el cual puede copiarse con exactitud para transmitir
dicha información a las células hijas. Sin embargo estas instrucciones
pueden ser modificadas levemente, es por eso que hay variaciones individuales
y un individuo no es exactamente igual a otro de su misma especie (distinto
color de ojos, piel, etc.). De este modo, podemos decir que el material
genético es lo suficientemente maleable como para hacer posible la evolución.
La información
genética o genoma, está contenida en unas moléculas llamadas ácidos nucleicos.
Existen dos tipos de ácidos nucleicos: ADN y ARN. El ADN guarda la información
genética en todos los organismos celulares, el ARN es necesario para que
se exprese la información contenida en el ADN; en los virus podemos encontrar
tanto ADN como ARN conteniendo la información (uno u otro nunca ambos).
Composición química y estructura
de los ácidos nucleicos
Los ácidos nucleicos resultan de la polimerización
de monómeros complejos denominados nucleótidos.
Un nucleótido
está formado por la unión de un grupo fosfato al carbono 5’ de una pentosa.
A su vez la pentosa lleva unida al carbono 1’ una base nitrogenada.

Fig. 2.36 - Estructura del nucleotido monofosfato de adenosina (AMP)
Las bases
nitrogenadas son moléculas cíclicas y en la composición de dichos anillos
participa, además del carbono, el nitrógeno. Estos compuestos pueden
estar formados por uno o dos anillos. Aquellas bases formadas por dos
anillos se denominan bases púricas (derivadas de la purina). Dentro de
este grupo encontramos: Adenina (A), y Guanina (G).
Si poseen un solo ciclo, se denominan bases pirimidínicas
(derivadas de la pirimidina), como por ejemplo la Timina (T), Citosina
(C), Uracilo (U).
Estos derivados de la purina y la pirimidina son las
bases que se encuentran con mayor frecuencia en los ácidos nucleicos.
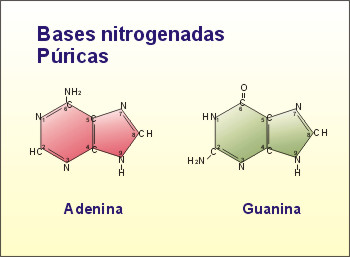
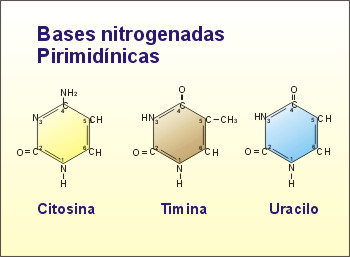


Fig. 2.37-
Bases púricas y pirimídicas
Fig. 2.38
- Bases menos frecuentes
Existen
otras bases nitrogenadas que son menos frecuentes, algunas de ellas están
metiladas. En eucariontes estas bases metiladas participan del control
de la expresión genética.
Nucleótidos
de importancia biológica
ATP (adenosin trifosfato):
Es el portador primario de energía de la célula. Esta molécula tiene
un papel clave para el metabolismo de la energía. La mayoría de
las reacciones metabólicas que requieren energía están acopladas a la
hidrólisis de ATP.
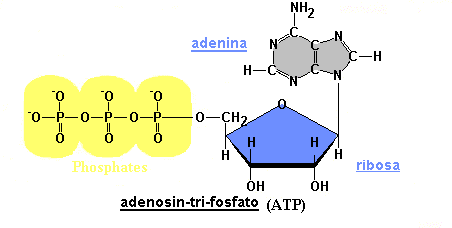

Fig. 2.39
- ATP (Adenosin trifosfato)

Fig. 2.40
- Estructura del AMPC
Este
nucleótido posee tres grupos fosfatos unidos entre sí. Estos grupos fosfatos
dado el pH celular se encuentran desprotonados, de manera que poseen cargas
negativas. Como estas cargas están muy cerca se repelen fuertemente.
Para mantenerlos juntos, se establecen uniones de alta energía entre los
fosfatos, por lo tanto, cuando la molécula se hidroliza la energía se
libera. Del mismo modo para sintetizar una molécula de ATP se requiere
energía.
AMP cíclico: Es una de las
moléculas encargadas de transmitir una señal química que llega a la superficie
celular al interior de la célula. segundo mensajero)

NAD+
y NADP+: (nicotinamida adenina dinucleótido
y nicotinamida adenina dinucleótido fosfato). Son coenzimas que intervienen
en las reacciones de oxido-reducción, son moléculas que transportan electrones
y protones. Intervienen en procesos como la respiración y la fotosíntesis.
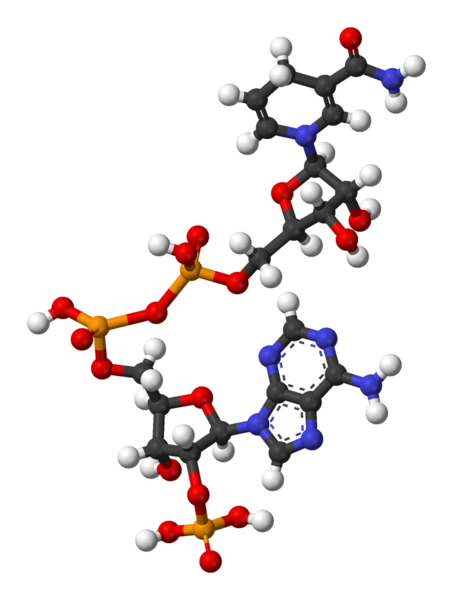



Fig. 2.41
- Estructura del NAD+, La nicotinamida acepta hidrogeniones, proceso denominado
reducción
FAD+: También es
un transportador de electrones y protones. Interviene en la respiración
celular.


Coenzima A:
Es una molécula que transporta grupos acetilos, interviene en la respiración
celular, en la síntesis de ácidos grasos y otros procesos metabólicos.


Polinucleótidos
Existen
dos clases de nucleótidos, los ribonucleótidos en cuya composición
encontramos la pentosa ribosa y los desoxirribonucleótidos,
en donde participa la desoxirribosa.
Los nucleótidos
pueden unirse entre sí, mediante enlaces covalentes, para formar polímeros,
es decir los ácidos nucleicos, el ADN y el ARN.
Dichas
uniones covalentes se denominan uniones fosfodiéster. El grupo
fosfato de un nucleótido se une con el hidroxilo del carbono 5’ de otro
nucleótido, de este modo en la cadena quedan dos extremos libres, de un
lado el carbono 5’ de la pentosa unido al fosfato y del otro el carbono
3’ de la pentosa.
Fig. 2.42
- Estructura de un polirribonucleótido
ADN – Ácido desoxirribonucleico
Los ácidos
nucleicos fueron aislados por primera vez en 1869, sin embargo no fue
hasta mucho después que se conoció su función. A principio de siglo los
científicos que querían explicar como se transmitía y se almacenaba la
información genética se enfrentaron a un problema, era el ADN o las proteínas
de los cromosomas los que portaban la información genética.
Se sabía que el ADN constaba de solo cuatro tipo de monómeros, frente a los 20 aminoácidos
que se encuentran formando parte de las proteínas, de manera que se pensaba
que era demasiado sencillo como para guardar la información, por lo cual
se le asignaba una función estructural.
La evidencia que ha servido para esclarecer la función
del ADN, ha procedido, por un lado, del hecho que la cantidad de ADN de
una especie es constante, sin importar la edad, sexo, factores nutricionales
o ambientales.
Por otra parte, la cantidad de ADN tiene mayoritariamente
una relación directa con la complejidad del organismo, así como también
se observa que las gametas de los individuos con reproducción sexual poseen
solo la mitad del ADN que posee cualquier de sus células somáticas.
Sin embargo
esto por si solo no confirmó la función del ADN. Por ello se llevaron
a cabo una serie de experimentos que lo demostraron en forma concluyente.
En 1928,
Griffith experimentó con distintas cepas de bacterias, una de ellas era
la forma llamada lisa (L), rodeada de una cápsula de polisacáridos y causante
de neumonía en los ratones. En contraste las cepas rugosas, no contenía
el polisacárido y no era virulenta.
Griffith
experimentó con ratones. A unos inyectándoles cepas lisas muertas por
calor, a otras cepas rugosas vivas y a otros una mezcla de cepa R viva
con cepa L muertas por calor, en este último caso los ratones morían de
neumonía, es decir que las células rugosas se habían transformado en cepas
virulentas. En 1944 se demostró que ese principio transformador era el
ADN y no las proteínas.
Fig.
2.43 - Experimento de Griffith
Otra
serie de experimentos realizados en 1952 por Hershey y Chase, demostraron
en forma indiscutible que el ADN es el material genético. Trabajaron
con virus llamados bacteriofagos; los bacteriofagos, están formados por
ADN y proteínas, las proteínas forman una cubierta y en su interior se
aloja el ADN. Se cultivaron virus en un medio que contenía fósforo radiactivo,
de manera que al sintetizar su ADN, la molécula quedaba marcada radiactivamente.
Otros virus se hicieron crecer en medio con azufre radiactivo, quedando
marcadas radiactivamente las proteínas. Los virus tienen un mecanismo
de acción muy particular, ya que no ingresan a la célula que infectan
sino que solo inyectan su material genético. Luego se pusieron en contacto
los virus que poseían las proteínas radiactivas con un cultivo de bacterias
y lo mismo se hizo con los virus que tenían el ADN marcado.
Fig. 2.44
- Experimento de Hershey y Chase
Si la
información genética estaba contenida en el ADN la marca radiactiva debía
estar en el interior de las bacterias de este último grupo, por el contrario
si eran las proteínas las que cumplían dicha función la marca radiactiva
estaría adentro de las bacterias del primer grupo. El resultado del experimento
confirmó que el ADN era la molécula que buscaban, ya que se encontraba
la marca radioactiva en el interior de las bacterias que se pusieron en
contacto con ADN marcado.
Una vez establecida su función faltaba determinar
su estructura, como era posible que esa estructura repetitiva almacenara
las distintas instrucciones.
En 1953 Watson y Crick propusieron el modelo de doble
hélice, para esto se valieron de los patrones obtenidos por difracción
de rayos X de fibras de ADN, y de los postulados enunciados por Chargaff
que estableció que la cantidad de adenina de una molécula de ADN era igual
a la cantidad de timina de la misma molécula y que la cantidad de guanina
era igual a la cantidad de citosina, es decir que el contenido de purinas
era igual al de pirimidinas.
Fig.
2.45 - Pares de bases del ADN: La formación específica de
enlaces de hidrógeno entre G y C y entre A y T genera los pares
de bases complementarias
El modelo de la doble hélice establece
que las bases nitrogenadas de las cadenas se enfrentan y establecen entre
ellas uniones del tipo puente de hidrógeno. Este enfrentamiento
se realiza siempre entre una base púrica con una pirimídica, lo que permite
el mantenimiento de la distancia entre las dos hebras. La Adenina se une
con la timina formando dos puentes de hidrógeno y la citosina con la guanina
a través de tres puentes de hidrógeno. Las hebras son antiparalelas, pues
una de ellas tiene sentido 5’ ® 3’, y la otra sentido
3’ ® 5’.
El modelo de Watson y Crick, describe a la molécula
del ADN como una doble hélice, enrollada sobre un eje, como si fuera una
escalera de caracol y cada diez pares de nucleótidos alcanza para dar
un giro completo.
Excepto en algunos virus, el ADN siempre forma una
cadena doble.
Factores
que estabilizan la doble hélice
Los puentes de hidrógeno entre las bases tienen un
papel muy importante para estabilizar la doble hélice, si bien individualmente
son débiles hay un número extremadamente grande a lo largo de la cadena.
Las interacciones
hidrofóbicas entre las bases también contribuyen con la estructura.
Los grupos fosfatos que se encuentran en el exterior
de la doble hélice pueden reaccionar con el agua aportando mayor estabilidad.
Fig.
2.46 - Una corta sección de la doble hélice de ADN
Fig. 2.47
- (a) Modelo de la doble hélice de ADN, (b) Representación
abreviada de un segmento de ADN
Funciones biológicas
El ADN es el portador de la información genética y
a través de ella puede controlar, en forma indirecta, todas las funciones
celulares.
Debemos recordar aquí que las enzimas son proteínas
que catalizan todas las funciones biológicas y se sintetizan en las células
de acuerdo a la información genética. Vale decir que a la información
genética la podemos comparar con un recetario, donde están las recetas
de todas las proteínas del organismo.
Encontramos ADN en el núcleo de las células animales
y vegetales, en los organismos procariontes, en organoides como los cloropastos
y mitocondrias, como así también en algunos virus, a los que llamamos
ADN - virus.
ARN – Ácido ribonucleíco
El ácido ribonucleíco se
forma por la polimerización de ribonucleótidos. Estos a su vez se forman
por la unión de:
a) un grupo fosfato. b) ribosa, una
aldopentosa cíclica y c) una base nitogenáda unida al carbono 1’
de la ribosa, que puede ser citocina, guanina, adenina y uracilo. Esta
última es una base similar a la timina.
En general los ribonucleótidos se unen entre sí, formando
una cadena simple, excepto en algunos virus, donde se encuentran formando
cadenas dobles.
La cadena simple de ARN puede
plegarse y presentar regiones con bases apareadas, de este modo se forman
estructuras secundarias del ARN, que tienen muchas veces importancia funcional,
como por ejemplo en los ARNt (ARN de transferencia).
Se conocen tres tipos principales de ARN y todos ellos
participan de una u otra manera en la síntesis de las proteínas. Ellos
son: El ARN mensajero (ARNm), el ARN ribosomal (ARNr) y el ARN de transferencia
(ARNt).
ARN mensajero (ARNm)
Fig.
2.48 - Esquema de una ARNm bacteriano
Consiste
en una molécula lineal de nucleótidos (monocatenaria), cuya secuencia
de bases es complementaria a una porción de la secuencia de bases del
ADN. El ARNm dicta con exactitud la secuencia de aminoácidos en una cadena
polipeptídica en particular. Las instrucciones residen en tripletes de
bases a las que llamamos codones. Son los ARN más largos y pueden tener
entre 1000 y 10000 nucleótidos
En los eucariontes los ARNm
derivan de moléculas precursoras de mayor tamaño que se conocen en conjunto
como ARN heterogéneo nuclear (hnARN), el cual presenta secuencias internas
no presentes en ARN citoplasmáticos.
ARN ribosomal (ARNr)
Este tipo de ARN una vez
transcripto, pasa al nucleolo donde se une a proteínas. De esta manera
se forman las subunidades de los ribosomas. Aproximadamente dos terceras
partes de los ribosomas corresponde a sus ARNr.
Fig.
2.49 - Diagrama de un ribosoma procarionte
ARN de transferencia
(ARNt)
Este es el más pequeño de
todos, tiene aproximadamente 75 nucleótidos en su cadena, además se pliega adquiriendo
lo que se conoce con forma de hoja de trébol plegada. El ARNt se encarga
de transportar los aminoácidos libres del citoplasma al lugar de síntesis
proteica. En su estructura presenta un triplete de bases complementario
de un codón determinado, lo que permitirá al ARNt reconocerlo con exactitud
y dejar el aminoácido en el sitio correcto. A este triplete lo llamamos
anticodón.
Fig. 2.50-
Molécula de ARNt
ARN
pequeño nuclear (ARNpn o
snRNA)
En eucariontes encontramos
un grupo de seis ARN que están en el núcleo, el ARN pequeño nuclear, estos
desempeñan cierto papel en la maduración del ARNm.
Ribozimas
Son
ARN que tienen función catalítica, participan activamente en la maduración
de los ARNm.
Función
de los ARN
Un gen
está compuesto, como hemos visto, por una secuencia lineal de nucleótidos
en el ADN, dicha secuencia determina el orden de los aminoácido en las
proteínas. Sin embargo el ADN no proporciona directamente de inmediato
la información para el ordenamiento de los aminoácidos y su polimerización,
sino que lo hace a través de otras moléculas, los ARN. Todo el proceso
que se lleva a cabo para la síntesis de proteínas se verá detalladamente
en otro capítulo.
Proteínas
Las proteínas
son las macromoléculas más abundantes en las células animales y constituyen
alrededor del 50% de su peso seco. Dentro de las células se las encuentra
en formas muy variadas: como constituyente de las membranas biológicas,
como catalizadores de reacciones metabólicas (enzimas), interactuando
con los ácidos nucleicos (histonas) o con neurotransmisores y hormonas
(receptores), etc. Prácticamente, no existe proceso biológico en el que
no participe por lo menos una proteína. Se las considera como el grupo
de compuestos que mayor cantidad de funciones desempeñan en los seres
vivos.
Estas moléculas son polímeros de aminoácidos unidos
por enlaces peptídicos.
Las proteínas
pueden ser simples o conjugadas. Las simples sólo están formadas por aminoácidos.
Las conjugadas contienen además de la o las cadenas polipéptidicas, grupos
no proteicos, denominados grupos prosteicos, por ejemplo la hemoglogina
o las lipoproteínas.
Para entender los aspectos estructurales y las características
químicas de las proteínas, es fundamental analizar primero la de sus monómeros.
Aminoácidos
Como
su nombre lo indica, cada aminoácido está formado por un grupo amino
y un grupo ácido carboxílico , unidos a un átomo de carbono
central o carbono a, el que además tiene unido siempre un átomo de hidrógeno y una cadena
lateral de características variables.
Por poseer
un grupo amino y un grupo carboxilo, los aminoácidos son anfolítos,
dependiendo del pH del medio su comportamiento como ácidos o bases.
Fig. 2.51 - Fórmula general
de
un aminoácido
El carbono central es asimétrico ya que está compartiendo
electrones con cuatro grupos diferentes, por eso los aminoácidos, con
excepción de la glicina, presentan actividad óptica, es decir, tienen
isómeros D y L. Solamente las formas L forman parte de las proteínas.
Fig.
2.52 - Fórmula general de los D y L-aminoácidos
Como
muestra la fórmula, el carbono central se encuentra unido a un grupo variable
o resto (R). Es en dichos grupos R, donde las moléculas de los veinte
aminoácidos [1] que forman parte
de las proteínas se diferencian unas de otras. En la glicina, el más simple
de los ácidos, el grupo R se compone de un único átomo de hidrógeno. En
otros aminoácidos el grupo R es más complejo, conteniendo carbono e hidrógeno,
así como oxígeno, nitrógeno y azufre.
De acuerdo con la naturaleza
del ”R” podemos clasificar a los aminoácidos en polares (con y sin carga)
y aminoácidos no polares.
Fig. 2.53 - Estructura química de los veinte aminoácidos clasificados en ácidos, básicos, neutros polares y neutros no polares. Las estructuras que se encuentran debajo de los grupos amino y carboxilo son las cadenas laterales R
Aminoácidos esenciales
La síntesis
proteica requiere de un constante aporte de aminoácidos. Los organismos
heterótrofos sintetizan gran parte de estos aminoácidos a partir de esqueletos
carbonados. Los que requieren ser incorporados por la ingesta, no pudiendo
ser sintetizados, se denominan aminoácidos esenciales, y son producidos
por plantas y bacterias (Tabla 2.4).
Tabla 2.4 - Aminoácidos no esenciales
y esenciales para el hombre
|
|
No
esenciales
|
Esenciales
|
Glutamato
|
Isoleucina
|
Glutamina
|
Leucina
|
Prolina
|
Lisina
|
Aspartato
|
Fenilalanina
|
Asparagina
|
Metionina
|
Alanina
|
Treonina
|
Glicina
|
Triptofano
|
Serina
|
Valina
|
Tirosina
|
Histidina
|
Cisteína
|
Arginina ( sólo en lactantes)
|
Aminoácidos y neurotransmisores
El impulso
nervioso pasa de una célula a otra en el proceso conocido como transmisión
sináptica. La transmisión sináptica esta mediada químicamente por moléculas
pequeñas llamadas neurotransmisores
Se conocen
muchos neurotransmisores distintos. Diferentes tipos de neuronas sintetizan
distintos neurotransmisores. Por ejemplo el sistema nervioso simpático
utiliza la adrenalina y la noradrenalina (catecolaminas), el sistema
nervioso parasimpático utiliza acetilcolina. Algunos neurotransmisores
derivan químicamente de los aminoácidos.
La adrenalina
y noradrenalina se sintetizan a partir de la tirosina, este paso ocurre
en el citosol de las neuronas adrenérgicas y células adrenales y los neurotransmisores
se almacenan en vesículas. El GABA otro neurotransmisor, se sintetiza
a partir del ácido glutámico, la histamina a partir de la histidina, la
serotonina a partir del triptófano. Cada uno de estos neurotransmisores
es sintetizado por neuronas especificas.
Fig. 2.54
- Formación de un enlace peptídico
Enlaces peptídicos, oligopeptidos y polipeptidos
Cuando una célula viva sintetiza proteínas,
el grupo carboxilo de un aminoácido reacciona con el grupo amino de otro,
formando un enlace peptídico, el producto de esta unión es un dipéptido.
El grupo carboxilo libre del dipéptido reacciona de modo similar con el
grupo amino de un tercer aminoácido, y así sucesivamente hasta formar
una larga cadena.
Los oligopéptidos contienen un número
indefinido pero pequeño de aminoácidos, mientras que los péptidos
y polipéptidos constan de un número mayor. Se consideran polipéptidos
a los polímeros de aminoácidos de un peso superior a 6000 Daltons.
Muchas moléculas de importancia biológica con
acción hormonal e incluso gran parte de los neurotransmisores son oligopéptidos
y péptidos, como se observa en los ejemplos citados en las tablas 2.5.
y 2.6.
Los polipéptidos naturales de 50 o más residuos
son considerados proteínas. Una proteína puede estar formada por una sola
cadena o por varias de ellas unidas por enlaces moleculares débiles. Cada
proteína se forma siguiendo las instrucciones contenidas en el ADN, el
material genético de la célula. Estas instrucciones son las que determinan
cuáles de los veinte aminoácidos se incorporan a la proteína, y en que
orden relativo o secuencia lo hacen. Los grupos R de los diferentes aminoácidos
establecen la forma final de la proteína y sus propiedades químicas. A
partir de las veinte subunidades pueden formarse una gran variedad de
proteínas.
| Tabla 2.5 - Péptidos con función hormonal | ||||
Nombre
|
Nº de aminoácidos
|
Órgano productor
|
Órgano blanco
|
Función
|
Oxitocina
|
9
|
Hipotálamo
|
Útero, glándula mamaria. | Contracción del múculo liso uterino y eyección de leche |
Vasopresina (ADH)
|
9
|
Hipotálamo
|
Riñón, vasos. | Antidiurética y vasopresora |
Hormona del crecimiento (GH)
|
191
|
Hipófisis
|
Acción generalizada | Crecimiento |
Hormona luteinizante (LH)
|
200
|
Hipófisis
|
Testículos y ovarios | Promueve la síntesis de los esteroides andrógenos y estrógenos, etc. |
Hormona Folículo estimulante (FSH)
|
200
|
Hipófisis
|
Testículos y ovarios | Crecimiento de tubos seminíferos y desarrollo folicular. |
Prolactina (PRL)
|
191
|
Hipófisis
|
Glándula mamaria | Estimula la secreción de leche |
Hormona adrenocorticotrofa (ACTH)
|
39
|
Hipófisis
|
Corteza adrenal | Estimula la secreción de corticoesteroides |
Tirotropina (TSH)
|
220
|
Hipófisis
|
Tiroides | Estimula secreción de tiroxina |
Paratohormona (PTH)
|
84
|
Paratiroides
|
Huesos, riñón e intestino. | Regulan la calcemia |
Calcitonina (CT)
|
32
|
Paratiroides
|
Huesos y riñón | |
Insulina
|
51
|
Páncreas
|
Tejidos insulino-dependientes. | Regulan la glucemia |
Glucagón
|
29
|
Páncreas
|
Acción generalizada | |
Tabla 2.6 - Algunos Péptidos con función neurotransmisora
|
||
| Nombre | Nº de aá. | Efecto |
| Sustancia P |
11
|
Dolor |
| Angiotensina II |
8
|
Ansiedad |
| Encefalinas (ENK) |
4
|
Control del dolor |
| Colecistoquinina(CCK) |
8
|
Regulación del apetito |
| Beta-endorfina |
31
|
Placer y analgesia |
Estructura proteica
Estructura
primaria
Es la secuencia ordenada y única de los aminoácidos
en la cadena polipeptídica, la cual está determinada genéticamente.
La estructura primaria es fundamental para
la forma tridimensional que tendrá la proteína. Cualquier modificación
en la secuencia de aminoácidos podría ocasionar un cambio en la estructura
tridimensional y afectará la función biológica de la proteína.
Fig.
2.55 - Estructura primaria de las dos cadenas polipeptídicas que
componen la insulina. La estructura primaria es la secuencia lineal de
aminoácidos, cada uno de los cuales está representado en
el diagrama por un óvalo. La letra en el interior de los óvalos
son los símbolos que indican el nombre de los aminoácidos.
La insulina es una proteína muy pequeña.
Debido
a la posibilidad de combinar los aminoácidos en cualquier orden y cantidad
es fácil comprender su versatilidad funcional.
Estructura
secundaria
A medida
que la cadena de aminoácidos se va ensamblando, empiezan a tener lugar
interacciones entre los diversos aminoácidos de la cadena. Pueden formarse
puentes de hidrógeno entre el hidrógeno del amino de un aminoácido y el
oxígeno del carboxilo de otro. A causa de estas uniones la cadena polipeptídica
se pliega, adoptando dos posibles configuraciones espaciales que constituyen
lo que se conoce como estructura secundaria de una proteína. Estas dos
configuraciones son las llamadas a-hélice
y b-hoja plegada. Estas conformaciones no son las
únicas que pueden adoptar las proteínas ya que en realidad cada proteína
adopta una forma característica que depende de la secuencia lineal. Sin
embargo las configuraciones antes mencionadas son las más frecuentes.
La a-hélice es un tipo de espiral cilíndrico estabilizado
por puentes de hidrógeno intracatenario, mientras que la b-hoja
plegada
está formada por cadenas polipeptídicas paralelas, mantenidas por puentes
de hidrógeno intercatenarios.
Fig.
2.56 - Esquema de una proteína presentando regiones con estructura
secundaria en a-Hélice, en Hoja b-Plegada y regiones con enroscamientos
aleatorios.
Existen porciones de la cadena polipeptídica
que no tienen estructura secundaria bien definida, y suelen denominarse
enroscamientos aleatorios o ad random
La proporciones de los distintos tipos de estructuras
secundaria varían de una proteína a otra, sin embargo podemos decir que
en la mayoría de las proteínas las formas a y b
suelen constituir entre el 60 y el 70 % del polipéptido y un 30% conforman
enroscamientos aleatorios
Diversas secciones consecutivas de estructuras
secundarias con frecuencia constituyen una estructura estrechamente asociada,
esto es reconocido como otro nivel de estructura proteica que se denomina
estructura supersecundaria. Existen varios ejemplos: el tipo b
a b donde
encontramos dos secuencias de b-plegada conectadas por una secuencia a.
Dominios
Se reconocen
como agrupamientos aproximadamente esféricos con unos 50 a 150 aminoácidos
que se forman por compactamiento local de la cadena polipeptídica. Una
proteína de más de 200 aminoácidos en general contiene dos o tres dominios.
Es difícil diferenciar la estructura supersecundaria del dominio, el dominio
podría ser sólo una estructura supersecundaria o varias de ellas combinadas
para dar un cúmulo compacto. El concepto de dominio es de utilidad ya
que muchas proteínas distintas tienen dominios similares, de modo que
parece ser que los dominios son unidades estructurales fundamentales,
por ejemplo muchas proteínas distintas se enlazan con el NAD+
por medio de un dominio llamado pliegue de mononucleótido.
Estructura
terciaria
Debido a la interacción de los grupos R, la
cadena polipeptídica se pliega determinando una intrincada estructura
tridimensional.
En muchas proteínas la estructura terciaria
le brinda a la proteína una forma globular, como por ejemplo en las enzimas,
que son proteínas con función catalítica.
Otras proteínas tienen estructura terciaria
fibrosa y suelen tener largas hélices o extensas hojas plegadas. Estas
proteínas fibrosas suelen tener función estructural como el colágeno.
Fig. 2.57
- Tipos de enlace que estabilizan la estructura terciaria de una proteína
El funcionamiento
de las proteínas depende del plegamiento de sus moléculas que da lugar
a configuraciones específicas y forma centros que pueden reconocer a la
molécula con la cual la proteína se asocia o reacciona durante el metabolismo
Fig. 2.58-
Estructura de la molécula de hemoglobina (estructura cuaternaria)
. Formada por dos cadenas de a-hemoglobina y dos cadenas de b-hemoglobina.
Cada cadena transporta una molécula de oxígeno
Estructura cuaternaria
Muchas proteínas presentan este tipo de estructura,
que es el grado máximo de organización proteica y consiste en dos o más
cadenas polipeptídicas unidas generalmente mediante enlaces débiles.
Estas proteínas se denominan oligoméricas
o multiméricas y se las designa según el número de cadenas polipeptídicas
que intervienen en la estructura cuaternaria. Por ejemplo, una proteína
formada por cuatro subunidades es un tetrámero, como es el caso de la
hemoglobina.
Cada
una de las subunidades proteícas, tienen su propia estructura terciaria.
Funciones
Biológicas de las proteínas
Las proteínas
dirigen la totalidad de los procesos celulares, incluso su propia síntesis.
Las funciones de mayor importancia de las proteínas en los seres vivos
son:
Función
estructural, como el colágeno, la tubulina de los microtúbulos,
las de las cápsides virales, etc. (Tabla 2.7).
Las moléculas de colágeno son ejemplos típicos
de las proteínas simples fibrosas. Son la clase de proteínas más abundantes
de nuestro cuerpo, son componentes de la matriz extracelular del tejido
conectivo, de modo que las podemos encontrar en tendones, ligamentos,
membrana basal, etc.
Aunque
existen distintos tipos de colágeno que se diferencian en las secuencias
de aminoácidos y en las proporciones con que se encuentran los mismos,
podemos hacer una generalización acerca de su estructura. El colágeno
es una proteína fibrosa que posee una estructura de orden superior. Esta
formado por unidades compuestas por tres cadenas polipeptídicas de aproximadamente
1000 aminoácidos cada una. Un tercio de esos aminoácidos está constituido
por la glicina, prolina e lisina hidroxiladas, constituyendo una estructura
rígida. El procolágeno, su unidad precursora, es secretado por el fibroblasto
a la matriz extracelular junto a dos enzimas. Estas enzimas catalizan
la separación de los extremos de la molécula de procolágeno para producir
la triple hélice de tropocolágeno. Las moléculas de tropocolágena se asocian
espontáneamente formando microfibrillas. Las microfibrillas se empaquetan
unas junto a otras para formar fibras de colágeno maduro.
Otro
ejemplo de proteínas simples fibrosas lo constituyen las queratinas, que
dan protección externa (piel, uñas, cabello, cuernos, etc.). Son producidas
por las células epidérmicas. En su estructura secundaria es en gran parte
a-hélice, en el caso particular de las queratinas del cabello
encontramos en su estructura primaria un gran número de cisteínas ( en
el R contienen grupos SH) lo que permite la formación de puentes disulfuro,
que son uniones covalentes que se dan entre dos grupos SH y que estabilizan
la estructura proteica. El calor o el tratamiento con determinados productos
químicos pueden reducir los puentes disulfuro, o bien formar puentes nuevos,
estirando u ondulando el cabello.
| Tabla 2.7 - Algunas Proteínas Fibrosas y sus Funciones | ||
Proteína
|
Origen
|
Función
|
| F-actina | Intracelular, todas las células. | Formación de microfilamentos en el citoesqueleto, movimiento contráctil. |
| Colágeno | Matriz extracelular, huesos, piel, vasos sanguíneos. | Resistencia a la tensión. |
| Desmina | Células musculares. | Estructuras que sirven de armazón dentro de la célula. |
| Elastina | Vasos sanguíneos, ligamentos. | Elasticidad. |
| Fibroína | Seda | Fuerza sin flexibilidad. |
| Queratina | Piel, cabello, etc. Intracelular. | Estructuras protectoras, resistencia a la tensión de los epitelios. |
| Lamina (Laminina nuclear) | Lamina nuclear. | Estructural. |
| Esclerotina | Exoesqueleto de los artrópodos. | Rigidez |
| Espectrina | Membrana de los eritrocitos. | Se enlaza con la F-actina, lo que permite que la membrana sea flexible. |
Función
Reguladora:
como las ciclinas que controlan el ciclo celular y los factores de transcripción
que regulan la expresión de los genes.
Función
Motora:
actina y miosina del músculo.
Función
de Transporte:
Globulinas en general, hemoglobima, mioglobina y las lipoproteínas son
algunos ejemplos.
Fig.
2.59 - Grupo Hemo, presente en la hemoglobina y la mioglobina.
La hemoglobina
y la mioglobina son proteínas globulares conjugadas, es decir que
en su estructura encontramos a parte del polipéptido un grupo no proteico
que en este caso corresponde al grupo Hemo.
La mioglobina
consta de una sola cadena polipeptídica asociada a un grupo hemo que es
el responsable de la unión del oxígeno, en tanto que la hemoglobina está
formada por cuatro cadenas polipeptídicas cada una con su correspondiente
grupo hemo. Por lo tanto la hemoglobina presenta estructura cuaternaria
lo que le permite variar su afinidad por él oxigeno, la cual se ve afectada
por el pH sanguíneo, la temperatura y la concentración de 2,3 DGP (2,3-
difosfoglicerato).
Función
de Reserva: La ovoalbúmina, componente
principal de la clara de huevo o la gliadina del trigo.
Función
de Receptores:
como las proteínas receptoras de membrana.
Función
Enzimática:
La enzimas catalizan todas las reacciones metabólicas. Dada su importancia
biológica, este tema será tratado con más detalle en el próximo capítulo.
Función
de Defensa: Los anticuerpos son proteínas simples globulares
y son sintetizadas por las células plasmáticas ( linfocitos B activados),
son también conocidas como inmunoglobulinas o gamaglobulinas. Estas proteínas
presentan gran diversidad ya que cada anticuerpo es específico para un
determinado antígeno. Sin embargo, podemos mencionar que en general
están compuestas por cuatro cadenas polipeptídicas dos contienen 220 aminoácidos
(cadenas livianas) y las otras más largas con 440 aminoácidos cada una
(cadenas pesadas).
Función
de mensajeros químicos: La mayor parte de las
hormonas son proteínas o glucoproteínas. También ciertos aminoácidos,
derivados de aminoácidos y oligopéptidos son neurotransmisores en el sistema
nervioso.
Desnaturalización
de las proteínas
Se denomina así a la pérdida de la estructura
tridimensional de las proteínas. Es decir su estructura secundaria, terciaria
o cuaternaria si la tuviera. Son agentes desnaturalizantes el calor, ácidos
y bases fuertes, radiaciones, etc.
La desnaturalización
no afecta la estructura primaria, estabilizada por enlaces covalentes.
En condiciones extremas de pH y temperaturas
se pueden llegar a romper los enlaces peptídicos de manera que se rompe
la estructura primaria, este proceso se denomina hidrólisis.
La desnaturalización
proteica es útil desde el punto de vista clínico ya que con frecuencia
es utilizada en distintos procedimientos. Un ejemplo lo constituye la
esterilización de elementos quirúrgicos, en donde el calor destruye las
proteínas de los microorganismos, lo mismo que algunos desinfectantes
como el alcohol.
actividades
de autoevaluación
1.
¿Qué
es un nucleótido?
2.
¿Qué
función cumple el ATP?
3.
¿Que
función cumplen el NAD y el FAD?
4.
¿Que
nucleótidos intervienen en la estructura del ADN?
5.
¿Cuales
son las diferencias estructurales entre el ADN y el ARN?
6.
¿Qué postula el modelo de Watson y Crick? ¿Qué importancia tiene en la duplicación
del ADN?
7.
Dibuja una doble hélice de
ADN realizando los siguientes pasos: a) Haz un espiral destacando lo que
iría por delante del papel con un trazo más grueso: b) comprueba que el
espiral gira a la derecha: c) construye otro espiral como el anterior,
pero desplazado ligeramente hacia arriba, d) señala los extremos de cada
cadena; e) coloca los peldaños y señala sobre el dibujo a qué corresponde
y dónde se situarán las pentosas y los fosfatos.
8.
Diseña una secuencia de 10
bases en una de las cadenas del ADN que acabas de realizar. ¿Cuál sería
la secuencia de la cadena complementaria? ¿Y la del ARN que se podría
formar con cada una de las cadenas? ¿Cuántas secuencias de ADN sería posible
obtener? ¿Qué longitud tendría este ADN9. ¿Cuáles son las fuerzas que intervienen en el mantenimiento de la estructura tridimensional de una proteína?
10. Escriba la estructura general de un aminoácido. ¿Cuál es la importancia del grupo R en la estructura de las proteínas?
11.
¿Qué
entiende por estructura primaria?
12.
¿Qué
tipos de aminoácidos conoce, en que se basa esa clasificación?
13.
¿Qué
estructuras se ven afectadas durante la desnaturalización proteica?
14.
¿Qué
proteínas con función estructural puede mencionar?
15.
¿Todas
las proteínas poseen estructura cuaternaria?
16.
¿Qué
determina la forma tridimensional de una proteína?
Preguntas de opción múltiple
1.
Un
nucleótido está formado por:
a.
un azúcar de 4 carbonos, un grupo fosfato y una base carbonada
b.
un azúcar de 5 carbonos, un grupo fosfato y una base nitrogenada
c.
un
azúcar de 5 carbonos, un grupo fosfato y una base hidrogenada
d.
un azúcar de 6 carbonos, una base nitrogenada y un grupo
fosfato e-
e.
ninguna
es correcta.
2.
¿Cuáles son los pares de bases que puede encontrar en la doble hélice
del ADN?:
a.
A-G
b.
A-C
c.
A-T
d.
T-U
e.
G-T
3.
¿ Qué fuerzas estabilizan la doble hélice del ADN? :
a.
puentes de hidrógeno
b.
interacciones hidrofóbicas
c.
interacciones
polares
d.
todas
son correctas
e.
ninguna
es correcta.
4.
En el experimento de Chase la marca radiactiva del ADN:
a.
aparece
fuera de la célula, comprobando que el ADN almacena la información genética
b.
está
dentro de la célula, comprobando así que es la molécula que almacena la
información
c.
aparece fuera de la célula demostrando que es patógeno
d.
aparece dentro de la célula demostrando que es estable
e.
ninguna
es correcta
5.
El ARN ribosomal :
a.
forma parte de los ribosomas
b.
se
sintetiza en los ribosomas
c.
se
une a los ribosomas
d.
interviene
en la maduración del ARNm
e.
ninguna
es correcta
6.
Podemos encontrar ARN de doble cadena en:
a.
las células procarionte
b.
en cloroplastos y mitocondrias
c.
en
algunos virus
d.
en
células vegetales
e.
todas
son correctas
7.
La unión peptídica se produce entre:
a.
el
grupo alcohol de un monosacárido y el grupo ácido de un ácido graso
b.
el
grupo amino de un aminoácido y el grupo ácido del mismo aminoácido
c.
el
grupo amino de un aminoácido y el grupo ácido de otro
d.
el
grupo amino de un aminoácido y el grupo fosfato
e.
ninguna
es correcta
Bibliografía
l
Alberts, B et al. (1996) Biología Molecular de la Célula. 3ra
Edición. Ediciones Omega S.A.Barcelona.
l
Campbell, N. (1997) Biology. 4th Edition. the Benjamin Cummings
Publishing Company. Inc.
California.
l
Curtis
y Barnes (1992). Biología. 5ª Ed. Bs.As. Editorial Médica Panamericana.
l
Harper,
(1995) Manual de Bioquímica. Ediciones El Manual Moderno. México.l Karp, G.. (1998) Biología Celular y Molecular. Ed. Mc Graw Hill Interamericana. México.
l Kuchel,p y Ralston, G. (1994) Bioquímica General. Serie Schaum. Ed. McGraw-Hill. México.
l
Smith and Wood. (1998)
. Moléculas Biológicas. Ed.Addison-Wesley. Iberoamericana S.A.
l
Solomon
y col. (1998) . Biología de Villee. 4ª. Ed.McGraw-Hill. Interamericana. México.
l
Stryer, L.. (1995) Bioquímica. Ed. Reverté. España.
[1] En la naturaleza
se han encontrado aproximadamente 150 aminoácidos, pero sólo 20 de ellos
están presentes en las proteínas.




No hay comentarios:
Publicar un comentario